Hapen poiston on happimolekyylien dissosiaatio hemoglobiinimolekyyleistä ihmisen veressä. Kehon hapenjakelu perustuu hapetus- ja hapenpoistojaksoon. Tämä sykli on häiriintynyt, kun esiintyy oireita, kuten savun hengittäminen.
Mikä on hapenpoisto?

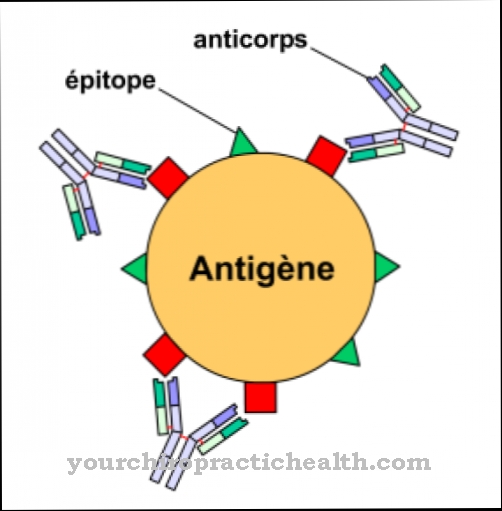
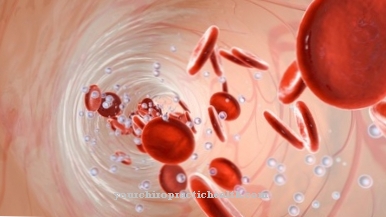
Kemiallisessa hapenpoistossa happiatomit vapautuvat atomisidoksesta. Lääketieteessä tarkoitetaan termiä hemoglobiinin happisitosten hajoamiseen. Hemoglobiini on punaveren pigmentti, joka sisältää kaksiarvoisia rauta-atomeja. Ihmisen hengityksessä hemoglobiini toimii kuljetusväliaineena tämän raudasidoksen ansiosta, jolla on affiniteetti happea kohtaan.
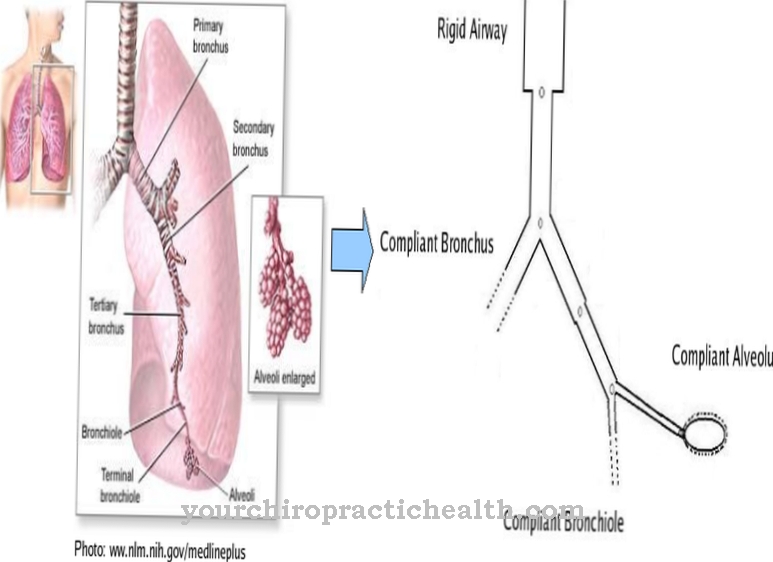
Kaikki kehon elimet ja kudokset tarvitsevat happea. Veri kuljettaa happiatomit verenkiertoon ohuimpiin oksiin ja toimittaa siten kaikki kudokset.
Hapen liukoisuus on vain rajoitettua. Siksi sitä ei ole vain vapaassa veriplasmassa, vaan myös hemoglobiiniin sitoutuneessa muodossa. Tätä sidosta kutsutaan myös hapetukseksi ja se on vastakohta hapettumiselle.
Hemoglobiinin sitoutumisaffiniteetti happea kohtaan muuttuu kehon erilaisissa ympäristöissä. Kun affiniteetti laskee, hapettuminen tapahtuu. Happiatomit vapautuvat kehon yksittäisiin kudoksiin ja elimiin. Sitovaa hemoglobiinia kutsutaan myös deoksihemoglobiiniksi. Samoin happea sitovaa hemoglobiinia kutsutaan oksihemoglobiiniksi.
Toiminto ja tehtävä
Hapetus ja hapenpoisto toimivat yhdessä ihmisen organismissa toimittaen kudoksille elintärkeää happea. Fysikaalisesti liuenneen hapen merkitys on esimerkiksi veriplasman ja keuhkojen alveolien välisessä vaihdossa. Hapenvaihto tapahtuu plasman ja interstitiumin välillä diffuusiolla. Fysikaalisesti liuenneen hapen on myös rooli tässä prosessissa.
Kaikkien solujen happea saatavuuden ylläpitämiseksi rajoitetun liukoisuuden vuoksi sitoutuminen hemoglobiiniin on myös elintärkeä prosessi. Kun hemoglobiini hapetetaan, sen rakenne muuttuu. Tämän asemanmuutoksen myötä keskusrauatomi muuttuu alueellisesti punaveripigmentissä ja hemoglobiinilla on dynaaminen toiminnallinen tila.
Ilman happea sitovaa hemoglobiini on itse asiassa deoksihemoglobiini ja sillä on siten jännittynyt T-muoto. Hapetuksen myötä hemoglobiinin muoto muuttuu rentoksi R-muotoon. Puhumme sitten oksihemoglobiinista. Hemoglobiinin affiniteetti happea kohtaan muuttuu molekyylien vastaavan muodon ja alueellisen järjestelyn kanssa. Rentoutuneessa muodossaan punaisella veripigmentillä on suurempi affiniteetti happea kohtaan kuin kireässä muodossa.
PH-arvolla on myös vaikutus affiniteettiin. Mitä korkeampi pH-arvo on vastaavassa vartaloympäristössä, sitä korkeampi on hemoglobiinin happea sitova affiniteetti. Lisäksi lämpötilat vaikuttavat sitoutumisominaisuuksiin. Esimerkiksi sitoutumisaffiniteetti happea kohtaan kasvaa lämpötilan laskiessa.
Lisäksi hapen sitoutumisaffiniteetti on riippuvainen hiilidioksidipitoisuudesta. Tähän riippuvuuteen hiilidioksidipitoisuudesta viitataan yhdessä pH-riippuvuuteen Bohr-ilmiönä. Hemoglobiinin sitoutumisaffiniteetti happea kohtaan laskee hiilidioksiditasojen noustessa ja alhaisessa pH-arvossa. Matalalla hiilidioksiditasolla ja korkealla pH-arvolla affiniteetti kasvaa. Tästä syystä hemoglobiini hapenee hengityksen aikana keuhkojen alveolaarisissa kapillaareissa, koska hiilidioksidipitoisuus laskee ja veren pH-arvo nousee.
Muun kehon verijärjestelmässä on kuitenkin suhteellisen korkeat CO2-pitoisuudet alhaisilla pH-arvoilla. Punaveren pigmentin sitoutumisaffiniteetti heikkenee. Happi dissosioituu hemoglobiinimolekyyleistä ja hapettuminen tapahtuu.
Ilman hapenpoistoa veri ei siksi olisi tehokas hapen kuljetusväliaine. Jos happimolekyylit pysyisivät pysyvästi sitoutuneina rautaan hemoglobiinissa, ei kehon kudokset eikä elimet hyötyisi kuljetuksesta.
Sairaudet ja vaivat
Hiilimonoksidimyrkytyksellä hemoglobiinin happea sitova toiminta heikkenee. Jos esimerkiksi potilas on hengittänyt liian paljon savukaasua tulipalo-olosuhteissa, hiilimonoksidi kerrostuu hemoglobiinin rautamolekyyleille hapen sijaan. Seurauksena on, että plasmassa on vähemmän oksihemoglobiinia. Kehossa ei juuri ole happea, koska punaveren pigmentin happeaffiniteetti laskee CO-pitoisuuden myötä. Hemoglobiinin hapenpoistoa suositaan vähenevän affiniteetin kanssa. Hypoksiaa esiintyy. Kehoa ei sitten enää tarvitse riittävästi happea.
Vakavan myrkytyksen tapauksessa on puhuttu anoksiasta. Yksi tällainen ilmiö on täydellinen hapen puute kehon kudoksissa. Vaikka anoksia liittyy melkein aina savun hengittämiseen, hypoksian syy voi olla myös anemia tai embolia. Esimerkiksi sirppisoluanemiasta kärsivät potilaat kärsivät kroonisesta anemiasta. Epänormaalilla hemoglobiinillasi on taipumus kutistua, tukkia verisuonia eikä hapettu enää riittävästi. Siksi sirppisoluanemia voi myös aiheuttaa hypoksiaa. Sama pätee ns. Alfatalasemiaan, jossa alfaketjujen synteesi hemoglobiinin proteiinikomponentissa on häiriintynyt.
Hypoksiassa solujen aineenvaihdunta on aina häiriintynyt. Runsasolut vaurioituvat aina riittämättömän hapen tarjonnan vuoksi. Riittämättömän tarjonnan vakavuus riippuu esimerkiksi siitä, kuinka nopeasti se voidaan korjata. Hapen antaminen on tärkeä vaihe useimpien puutteiden hoidossa. Verensiirto on yleensä välttämätöntä verenmuodostussairauksien tai hemoglobiinin häiriöiden hoidossa.






.jpg)