enteropeptidaasiproteiinien on pohjukaissuolen limakalvon entsyymi, jonka tehtävänä on aktivoida haiman entsyymejä. Se on ruoansulatusentsyymien koko aktivaatiokaskadin alussa. Enteropeptidaasin toimintahäiriöt johtavat ruuansulatukseen ja imeytymiseen ohutsuolessa.
Mikä on enteropeptidaasi?
Enteropeptidaasi on pohjukaissuolen limakalvon entsyymi, joka aktivoi haiman ruuansulatukselliset entsyymit aktivoimalla trypsinogeenin trypsiiniksi.
Enteropeptidaasi erittyy pohjukaissuolen limakalvon harjan reunaan. Erityisesti liebekühnin rauhaset ovat vastuussa erityksestä. Liebekühnin rauhaset ovat putkimaisia masennuksia ohutsuolen epiteelissä. Ohutsuolessa ne sijaitsevat ohutsuolen välissä. Rauhaset, jotka tunnetaan myös nimellä Lieberkühn-kryptat, erittävät enteropeptidaasin lisäksi suuren määrän entsyymejä. Enteropeptidaasin eritystä stimuloidaan, kun kymen, joka on ennalta sulatettu mahassa, saapuu pohjukaissuoleen. Pelkästään entsyymi ei vaikuta elintarvikkeiden komponentteihin.
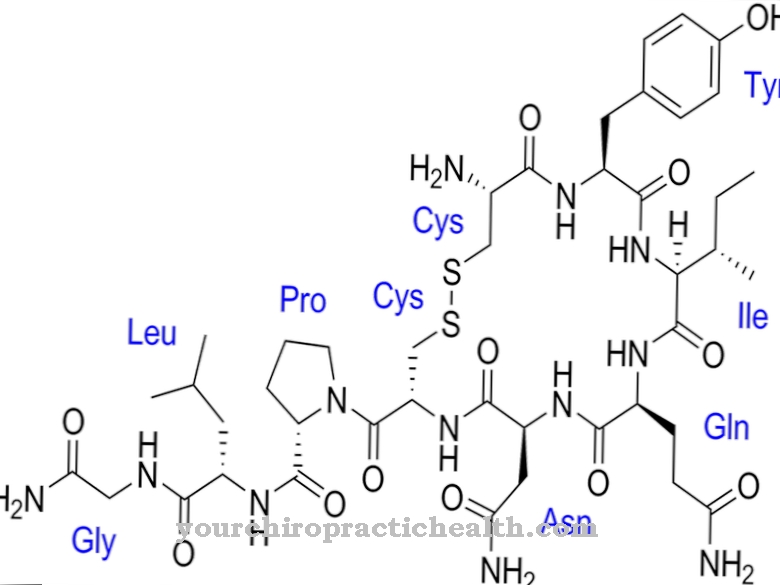
Vain trypsiini-entsyymin aktivointi asettaa ruuansulatuksessa käytettävien entsyymien koko aktivaatiokaskadin liikkeelle. Enteropeptidaasi, kuten trypsiini ja muut haiman proteaasit, on seriiniproteaasi. Aktiivinen keskus sisältää asparagiinihapon, histidiinin ja seriinin katalyyttisen triadin. Endopeptidaasina enteropeptidaasi pilkkoo proteiineja vain tietyissä tunnuspisteissä tietyillä aminohapposekvenssin tunnistusmotiiveilla. Entsyymi katkaisee aina Asp-Asp-Asp-Asp-Lys-tunnistusmotiivilla. Trypsinogeenin avulla heksapeptidi Val- (Asp) 4-Lys pilkotaan, jolloin muodostuu trypsiiniä.
Toiminto, vaikutukset ja tehtävät
Enteropeptidaasin tehtävänä on aktivoida haiman ruuansulatuksen entsyymit. Se aloittaa vain ensimmäisen aktivointivaiheen muuttamalla trypsinogeeni trypsiiniksi.
Trypsiini on puolestaan seriiniproteaasi, joka pilkkoo proteiineja saman tunnusomaisen tunnistusmotiivin perusteella. Se jatkaa nyt itse trypsinogeenin aktivointia. Samanaikaisesti se aktivoi muita haiman entsyymejä niiden vastaavista esiasteista, kuten kymotrypsinogeeni, pro-elastaasi, pro-karboksipeptidaasi, pro-fosfolipaasi ja proenteropeptidaasi. Enteropeptidaasi on myös aluksi passiivisessa muodossa. Kun kymen saapuu pohjukaissuoleen, ei vain proenteropeptidaasia, vaan myös pohjukaiskaista erittyy, mikä aktivoi enteropeptidaasin muodon. Aktivaatiokaskadin alkamisen jälkeen trypsiini ottaa kaikkien haiman entsyymien aktivoinnin mukaan lukien proenteropeptidaasi ja trypsinogeeni.
Proenteropeptidaasin aktivaatio enteropeptidaasiksi tapahtuu vieläkin tehokkaammin trypsiinin vaikutuksen kautta kuin pohjukaisjuomien kautta. Ruoansulatusentsyymien ensisijainen läsnäolo niiden inaktiivisessa muodossa on erittäin tärkeä. Erityisesti proteaasien vaikutus on epäspesifinen. Kaikki proteiinit, jotka sisältävät tyypillisen tunnistusmotiivin molekyylissä, pilkotaan hydrolyyttisesti. Jos entsyymit olisivat katalyyttisesti aktiivisia välittömästi, kehon omat proteiinit sulavat jo haimassa ja haiman kanavassa. Seurauksena haima liukenee. Aktivointi tapahtuu vain pohjukaissuolessa eksokriinisten rauhasten ulkopuolella.
Entsyymit voivat alkaa hajottaa ruokakomponentit hyökkäämättä kehon omiin kudoksiin. Ylimääräinen trypsiini-inhibiittori toimii haiman kanavassa estämään entsyymien aktivoitumista ennenaikaisesti. Ruoansulatuskanavan avainasemassa on kuitenkin trypsiini. Kun tämä entsyymi on aktivoitu, kaikkien ruoansulatusentsyymien, mukaan lukien enteropeptidaasi, aktivointia ei voida pysäyttää.
Koulutus, esiintyminen, ominaisuudet ja optimaaliset arvot
Kuten kaikilla seriiniproteaaseilla, myös enteropeptidaasilla on epäspesifinen vaikutus ja se katkaisee proteiinit käyttämällä tunnusomaista tunnistus motiivia. Enteropeptidaasi koostuu kevyestä ja raskaasta ketjusta, jotka on kytketty disulfidisiltoilla. Seriiniproteaasidomeeni sijaitsee kevyessä ketjussa.
Raskaan ketjun molekyylimassa on 82 - 140 kilodaltonia, kevyen ketjun molekyylimassan ollessa 35 - 62 kilodaltonia. Enteropeptidaasin kevytketjuinen rakenne on samanlainen kuin muut seriiniproteaasit trypsiini ja kymotrypsiini. Raskas ketju on sitoutunut membraaniin ja vaikuttaa entsyymin spesifisyyteen. Todettiin, että eristetyllä kevyellä ketjulla on samanlainen vaikutus tunnusomaista tunnistusmotiivia - (Asp) 4-Lys- vastaan, mutta huomattavasti alhaisempi vaikutus trypsinogeeniä vastaan.
Sairaudet ja häiriöt
Ihmisen enteropeptidaasia koodaa ENTK-geeni kromosomissa 21. Tämän geenin mutaatio voi johtaa vakaviin sairauksiin kärsivissä lapsissa.
Entsyymi ei voi enää aktivoida muita ruoansulatusentsyymejä. Ruokakomponentit eivät enää hajoa, joten ohutsuole ei voi enää absorboida niitä. Kyse on ensisijaisesti ruuansulatuksesta (riittämättömästä hajoamisesta), mikä johtaa elintarvikkeiden komponenttien imeytymiseen. Kehoon ei enää ole riittävästi ravintoaineita. Epäonnistuminen, kasvun hidastuminen ja tyypilliset proteiinivajeen oireet edeeman kanssa kehittyvät. Samaan aikaan proteiinien lisäksi hiilihydraatit ja rasvat imeytyvät huonosti. Koska pilkottamattomat ruokakomponentit pääsevät paksusuoliin ja hajoavat siellä käymisellä ja putrefaktiivisilla bakteereilla, ilmaantuu myös ilmavaivoja, ripulia ja vatsakipuja.
Toistaiseksi maailmanlaajuisesti on kuvattu 15 synnynnäisen enteropeptidaasin puutostapausta. Tilan oireet ovat kuitenkin paljon yleisempiä. Enteropeptidaasin puutteen ei tarvitse aina olla läsnä. Koska trypsiinillä on avainasemassa ruuansulatuksellisten entsyymien aktivoinnissa, trypsiinin vika tai puute johtaa myös vastaaviin oireisiin. Näiden sairauksien hoito on sama molemmissa tapauksissa. Entsyymit annetaan aktivoidussa muodossa. Enteropeptidaasin vajavuudesta on varmasti paljon enemmän diagnooseja.
Jos diagnoosi on varma, enteropeptidaasi voidaan myös korvata. Enteropeptidaasipuutos laukaisee myös toissijaisesti vakavien suolistosairauksien vuoksi.Sairaudet, kuten keliakia, lyhennetty ohutsuola, laktaasinpuutos tai muut, tulisi selvittää erotusdiagnoosissa.








.jpg)

.jpg)





.jpg)