Noin puolet kaikista proteiineista on ihmiskehossa glykoproteiinit. Aineilla on merkitys solukomponenteina sekä immuunijärjestelmissä. Ne muodostuvat pääasiassa osana ns. N-glykosylaatiota ja voivat aiheuttaa vakavia sairauksia, jos niitä ei ole koottu oikein.
Mitä glykoproteiinit ovat?
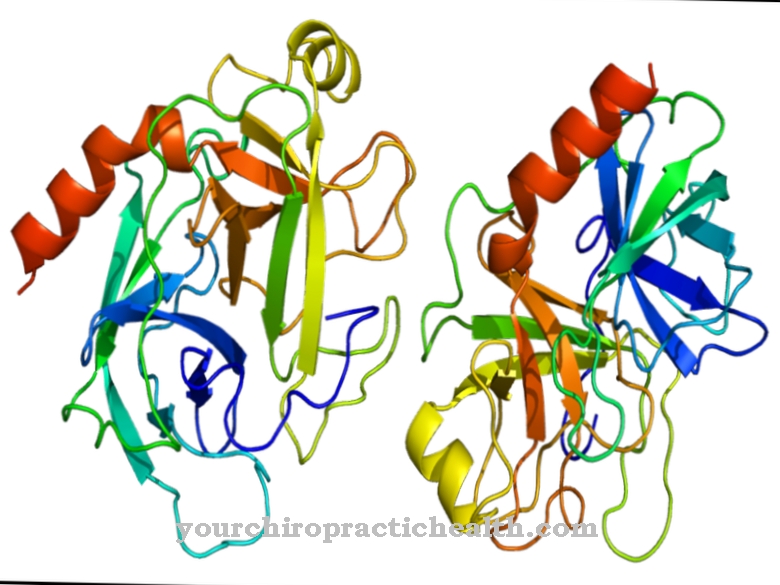
Glykoproteiinit ovat proteiineja, joissa on puumaisia haaroittuneita heteroglykaanitähteitä. Niiden koostumus on yleensä viskoosi. Makromolekyylit sisältävät kovalenttisesti sitoutuneet sokeriryhmät.
Ne koostuvat monosakkarideista, kuten glukoosista, fruktoosista, mannoosista tai asetyloidusta aminosokerista. Siksi niitä tunnetaan myös proteiineihin sitoutuneina oligosakkarideina. Kovalenttinen sidos voi tapahtua eri tavoin ja vastaa joko sidosta aminohappoihin seriini tai asparagiini. Sidosta seriiniin kutsutaan O- ja sitä asparagiini-N-glykosylaatioon. N-glykosylaatioon osallistuvat glykoproteiinit vaihtelevat kooltaan. Ne vastaavat monosakkarideja, di- tai oligosakkarideja ja jopa polysakkarideja.
Monosakkaridien osuuden mukaan ne jaetaan suurmannoosisiin, kompleksi- ja hybridi glykoproteiineihin. Mannoosirikkaassa ryhmässä mannoositähteet ovat pääosin. Monimutkaisessa ryhmässä sakkaridit ovat hallitsevia. Hybridiryhmä on hybridi. Glykoproteiinien hiilihydraattipitoisuus on välillä muutamia prosentteja ribonukleaaseilla ja jopa 85 prosenttia veriryhmäantigeeneillä.
Toiminto, vaikutukset ja tehtävät
Glykoproteiinit suorittavat lukuisia toimintoja ihmisen organismissa. Ne ovat solukalvojen rakenneosa ja niihin viitataan tässä yhteydessä myös rakenneproteiineina. Niitä löytyy myös limasta ja niitä käytetään nesteiden voiteluaineina.
Kalvoproteiineina ne edistävät solujen vuorovaikutusta. Joillakin glykoproteiineilla on myös hormonaalisia toimintoja, kuten kasvutekijä hCG. Aineet ovat yhtä tärkeitä kuin immunologiset komponentit immunoglobuliinien ja interferonien muodossa. Kaikki kehon vientiproteiinit ja membraaniproteiinit olivat edelleen glykoproteiineja, ainakin biosynteesin aikana. Ne ovat erityisen tärkeitä immuunijärjestelmän tunnistusreaktioissa, koska ne ovat vuorovaikutuksessa immunologisten T-solujen ja T-solureseptoreiden kanssa. Ihmisen veriplasmasta on eristetty erilaisia plasmaproteiineja, joista vain albumiinilla ja esialbumiinilla ei ole sokerijäännöksiä.
Glykoproteiinien runsaus on uskomatonta. Viime kädessä melkein kaikki solunulkoisesti liukoiset proteiinit ja entsyymit sisältävät sokerijäännöksiä. Hormonina glykoproteiineilla on pleiotrooppinen vaikutus ja siksi ne ovat kriittisen tärkeitä eri elinjärjestelmien toiminnalle. Hormonit TSH, HCG ja FSH ovat esimerkiksi glykoproteiineja. Kalvoproteiineina ne ovat edustettuina reseptoreissa, samoin kuin kuljettajina ja stabilointiaineina. Niillä on stabiloiva vaikutus, etenkin yhdessä glykolipidien kanssa. Yhdessä näiden aineiden kanssa ne muodostavat ns. Glykokalyksin, joka stabiloi soluja ilman soluseinää.
Koulutus, esiintyminen, ominaisuudet ja optimaaliset arvot
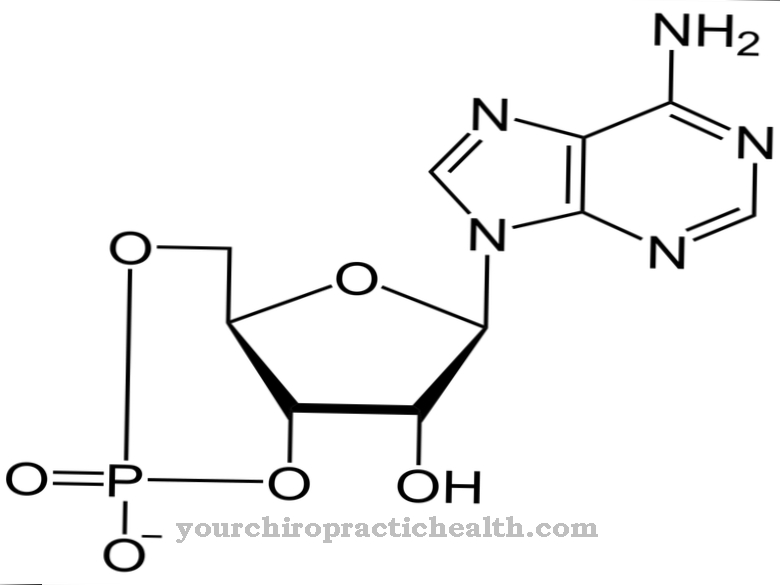
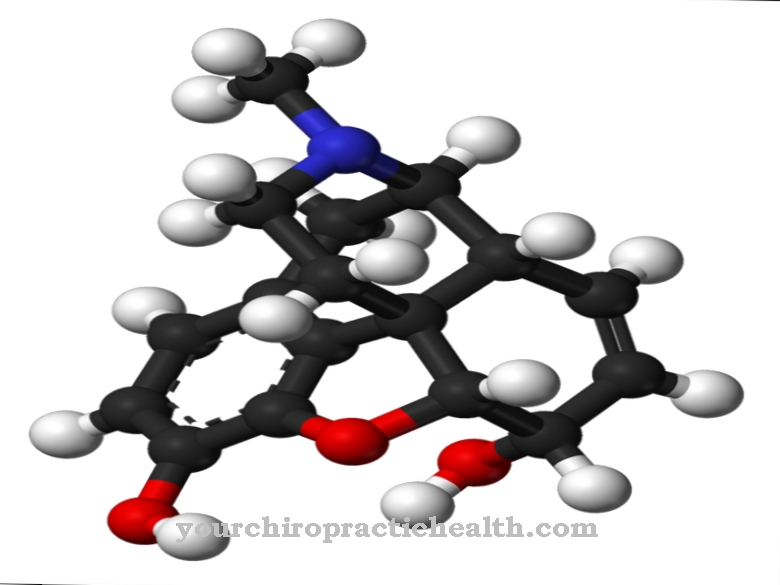
Yleisin glykoproteiinien muodostuminen on N-glykosidinen sidos tai N-glykosylaatio asparagiiniksi. Sokeri sitoutuu itse typpivapaisiin happoamidiryhmiin. N-glykosylaatio tapahtuu endoplasmisessa retikulumissa. Siten muodostuneet N-glykosidit ovat merkityksellisin glykoproteiiniryhmä.
N-glykosylaatiossa sokerin esiaste siettii kantajamolekyylin dolicholia riippumatta kohdeproteiinin aminohapposekvenssistä. OH-ryhmä molekyylin päässä on kytketty difosfaattiin. Oligosakkaridiprekursori muodostuu molekyylien terminaaliseen fosfaattijäännökseen. Seitsemän ensimmäistä sokeria kokoontuvat sytosolipuolelle. Dolicholifosfaattiin on kiinnitetty kaksi N-asetyyliglukosamiinia ja viisi manoositähdettä. Sokerinukleotidit GDP-mannoosi ja UDP-N-asetyyli-glukosamiini esiintyvät luovuttajina. Prekursori kuljetetaan ER-kalvon läpi kuljetusproteiinin kautta.
Prekursori on täten suuntautunut endoplasmisen retikulumin sisäpuolelle, jossa siihen lisätään neljä mannoositähdettä. Lisäksi kasvatetaan glukoositähteitä. 14 sokeria pitkä prekursori siirretään lopulta proteiiniin. Toinen glykoproteiinien muodostumisreitti on O-glykosidinen sidos tai O-glykosylaatio seriiniin, joka tapahtuu solujen Golgi-laitteistossa. Sokeri on sitoutunut seriinin hydroksyyliryhmään. Glykoproteiiniarvot ovat erityisen merkityksellisiä suhteessa plasmaproteiineihin, koska niillä on merkitys täydellisessä verenlaskussa. Kaikkien glykoproteiinien normaaliarvojen luetteleminen erikseen tässä vaiheessa menisi soveltamisalan ulkopuolelle.
Sairaudet ja häiriöt
Joillakin geneettisillä sairauksilla on vaikutuksia glykosylaatioon. Yksi ryhmä sellaisia sairauksia on CDG. Glykoproteiinien arvot ovat epänormaalit. Ne, joita kärsivät, kärsivät hitaasta kehityksestä, joka liittyy sekä fyysisiin että henkisiin ongelmiin.
Leikkuu voi olla toinen oire geneettiselle häiriölle. Glokoproteiinien muodostumiseen osallistuu yhteensä noin 250 erilaista geeniä. Synnynnäisten glykosylaatiohäiriöiden tapauksessa häiriöt hiilihydraattien sivuketjujen kiinnittymisessä proteiineihin johtuvat geneettisestä jakautumisesta. Translaation jälkeisessä modifikaatiossa proteiinit saavat täyden toiminnallisuutensa. Tässä prosessissa, kun hiilihydraattisia sivuketjuja rakentavat entsyymit tai proteiinit kootaan epänormaalisti yhteen, syntyy CDG. Häiriöt vaikuttavat yleisimmin N-glykosylaatioon. Tähän mennessä on löydetty noin 30 entsyymivirhettä, joilla on vaikutusta N-glykosylaatioon.
Geneettiset O-glykosylaatiohäiriöt ovat jonkin verran harvinaisempia. Ne ilmenevät neuromuskulaarisissa monijärjestelmän sairauksissa, kuten Walker-Warburgin oireyhtymässä. Koska glykoproteiineilla on niin monia toimintoja organismissa, kliiniselle kuvalle on ominaista monenlaiset oireet. Syntyneet glykosylaatiohäiriöt voivat vaikuttaa kaikkiin elinjärjestelmiin. Psykomotoriset kehityshäiriöt ovat tärkein oire. Neurologiset poikkeavuudet ovat yhtä yleisiä. Koagulaatiohäiriöt tai endokriiniset häiriöt eivät myöskään ole harvinaisia.



.jpg)






.jpg)